Remdesivir: tratamento para a Covid-19 coleciona polêmicas apesar dos primeiros resultados positivos
Último estudo demonstrou bons resultados apenas em pacientes menos graves
A Gilead divulgou mais informações sobre o estudo que analisa o uso do antiviral remdesivir para o tratamento da Covid-19. Em divulgação anterior, que serviu de parâmetro para que os EUA liberassem o antiviral para uso hospitalar, o estudo já tinha apontado a diminuição de dias para a recuperação de pacientes. Nos dados mais amplos, divulgados no New England Journal of Medicine (NEJM) na sexta-feira (22), foi verificada a aceleração no tempo de recuperação dos pacientes.
Por outro, lado, o estudo indica que a terapia é mais indicada para pacientes com condições menos graves, pois não foi demonstrado benefício para pacientes que precisavam de ventilação mecânica. O remdesivir, é a nova aposta da indústria farmacêutica, após a cloroquina e seu derivado hidroxicloroquina, terem apresentado resultados aquém do esperado, ao menos neste momento.
O portal Setor Saúde analisa o estudo e algumas questões importantes como a quebra de patente, primeiro genérico do remdesivir lançado em Bangladesh, o possível custo do medicamento e o uso no Brasil.
Menos dias para se recuperar: Em pacientes com menos gravidade
O estudo de 1.063 pacientes incluiu 538 que receberam remdesivir e 521 que receberam placebo. Aqueles que receberam remdesivir se recuperaram em uma média de 11 dias, em comparação com 15 dias para aqueles que receberam placebo. A mortalidade no grupo remdesivir foi de 7,1%, em comparação com 11,9% no grupo placebo, mas essa diferença não foi estatisticamente significativa.
Stephen Evans, professor de farmacoepidemiologia da Escola de Higiene e Medicina Tropical de Londres aponta ainda outro estudo, com resultados similares. “Com a redução do tempo de recuperação, eles [os dados do estudo] são definitivamente convincentes, embora não seja uma diferença enorme, mas muito útil, de 4 dias. Isso é compatível com os resultados de um estudo da China com uma amostra pequena (236 pessoas), publicado no The Lancet. Embora exista uma evidência de que o remdesivir seja eficaz, ele não altera drasticamente o curso da doença. ”
Eric Topol, diretor e fundador do Scripps Research Translational Institute (EUA), acredita que o remdesivir “é um medicamento muito seguro e eficaz”, mas reforçou que não havia sinal de benefício nos pacientes que iniciaram o estudo com a condição mais grave da doença – aqueles que estavam em ventilação não invasiva, intubados ou que estavam recebendo oxigenação extracorpórea por membrana (ECMO) – tratamento em que o oxigênio é adicionado ao sangue por meio de um equipamento externo que simula a função do pulmão. “Precisamos conseguir algum tratamento que funcione para esses pacientes [graves] que apresentam uma alta taxa de mortalidade”, disse Topol.
As polêmicas sobre a Gilead e o remdesivir: Estudo
A disponibilização do remdesivir, desenvolvido pela Gilead, tem sido escassa, já que a empresa tem tido dificuldades para atender a grande demanda, seja pela dificuldade em adquirir insumos como para utilizar a sua limitada capacidade fabril atual. Portanto, saber quais pacientes podem se beneficiar é muito importante para decidir quem deve receber o medicamento.
No estudo, houve dúvidas em relação à taxa de mortalidade. Alguns críticos identificaram falhas no estudo que poderiam afetar a interpretação dos dados. Os cientistas que avaliaram o estudo afirmam que o mesmo foi interrompido antes do previsto, depois de um alerta do conselho de segurança e monitoramento de dados – um painel de especialistas externos encarregados de proteger os pacientes que integram o estudo. O grupo notificou o NIAD – Instituto Nacional de Alergia e Doenças Infecciosas -, órgão ligado ao Ministério da Saúde dos EUA.
Segundo o site Stat, o periódico cientifico New England Journal não apontou, como é normalmente habitual, que o estudo foi interrompido. O mesmo site havia divulgado há duas semanas, que o estudo foi descontinuado, em função de discussões relacionadas à ética médica e pesquisa clínica.
“Está claro na publicação que o estudo foi interrompido antes da conclusão com um número significativo de pacientes [previsto inicialmente]”, disse Steven Nissen, cardiologista da Cleveland Clinic, de Cleveland (EUA). “Ao interrompê-lo mais cedo, a comunidade científica foi privada da oportunidade de determinar se o remdesivir pode ou não reduzir a mortalidade.”
De acordo com o artigo, em 28 de abril de 2020, um total de 391 pacientes no grupo remdesivir e 340 no grupo placebo haviam terminado os 29 dias de estudo programado, com alguns se recuperando ou vindo à óbito. Mas ainda havia 132 pacientes no grupo remdesivir e 169 no grupo placebo que não haviam se recuperado ou completado o acompanhamento. A afirmação de Nissen é que, se o estudo tivesse sido autorizado a seguir como estipulado, seria mais claro identificar se o medicamento melhoraria ou não as chances de sobrevivência dos pacientes.
Topol disse que interpreta o benefício de sobrevivência como “bastante provável” e que “não se incomoda” pelo fato de o resultado da mortalidade não ser significativo. Ele disse que aguarda resultados de ensaios futuros que possam responder esta questão em particular.
As polêmicas sobre a Gilead e o remdesivir: Acesso
Com um faturamento de 22,5 bilhões de dólares (2019), a Gilead Sciences, fundada em 1987 na Califórnia (EUA), acumulou lucro de 5,4 bilhões de dólares no último ano. A empresa tem um valor de mercado de mais de 100 bilhões de dólares na Nasdaq, bolsa de valores de Nova York.
Desde que começou a se tornar um dos principais candidatos para tratamento de pacientes com Covid-19, a fabricante detentora da patente vem sendo pressionada a deteminar um preço a ser cobrado e, principalmente, definir o quanto antes, se estaria disposta a liberar a patente para as nações, ricas ou pobres, pudessem ter acesso ao tratamento.
Após o remdesivir ter sido aprovado para uso emergencial nos Estados Unidos no dia 1º de maio, o Japão autorizou o tratamento de pacientes com o uso da droga – somente para pacientes graves –, no dia 11 de maio.
Com estas duas autorizações, além dos primeiros dados do estudo divulgado em 10 de abril – inclusive em uma cerimônia com a presença do presidente dos EUA, Donald Trump -, os preços das ações da empresa na bolsa de valores dos EUA, passou de 65 dólares a 84 dólares em poucos dias. Hoje o valor da ação está em 73 dólares (22/05).
O presidente da Gilead, Daniel O’Day (ao centro na foto), disse em comunicado divulgado no final de abril, que a empresa está trabalhando para construir um consórcio que possa expandir a capacidade de produção global. “Será essencial que os países trabalhem juntos para criar oferta suficiente para as pessoas em todo o mundo e estamos ansiosos para alavancar esses esforços colaborativos”, escreveu O’Day.
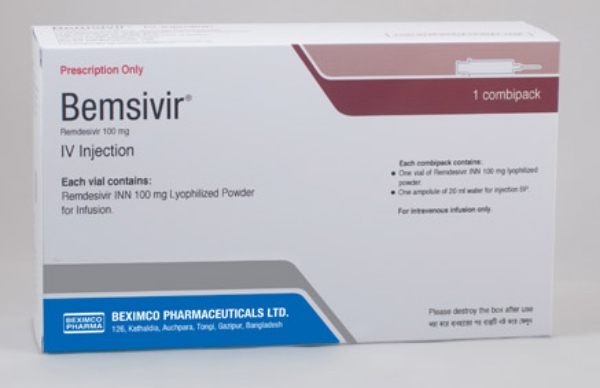
Bangladesh produz genérico
Em Bangladesh, o fabricante de medicamentos Beximco Pharmaceuticals, tornou-se a primeira empresa a anunciar que venderá uma versão genérica do remdesivir. Segundo o site Stat, este é o primeiro passo para que países mais pobres possam ter acesso ao medicamento que tem dado as melhores respostas até o momento. O remdesivir (registrado como bemsivir em Bangladesh) não estará disponível nas farmácias de varejo, conforme comunicado oficial no site da empresa.
Após um decreto de emergência emitido pelo governo de Bangladesh, a Beximco informou que doará o medicamento para hospitais administrados pelo estado. Para hospitais e clínicas privadas, o tratamento será cobrado. Além disso, a empresa informou estar disposta a exportar a versão genérica se outros países solicitarem – embora não tenha uma licença da Gilead especifica para isto.
A Beximco conseguiu dar esse passo em função de um acordo baseado nas disposições da Organização Mundial do Comércio, que permite que um país “menos desenvolvido” conceda a um órgão público ou a uma empresa a licença para produzir um medicamento/produto patenteado sem o consentimento do titular da patente durante a pandemia.
Dada a extensão da pandemia, a patente se tornou um tópico cada vez mais importante. Vários países, inclusive o Brasil, estão trabalhando para mudar leis que garantam a quebra de patentes de produtos e medicamentos que possam ser utilizados contra a Covid-19, conforme a OMC preconizou.
Quanto vai custar?
O valor do remdesivir, segundo especialistas, pode ter uma ampla variação de preço, dependendo das negociações em relação à garantia de compra e quantidade adquirida por cada país. Paul Fehlner, ex-chefe global de propriedade intelectual da Novartis, disse ao site Stat, que o valor ideal seria de 12,50 dólares por paciente (para 10 dias de tratamento).
Para ele, a Gilead deve deixar de lado os lucros enquanto o novo coronavírus continuar sendo um problema não controlado. Isso significa que o remdesivir deve ter o preço “pelo custo de fabricação mais uma margem razoável, digamos 25%”, defendeu Fehlner.
A Gilead não divulgou os custos de produção do remdesivir, embora uma projeção recente publicada no Journal of Virus Eradication tenha sugerido que a despesa seria de 0,93 dólares por dia de suprimento. Com base nessa análise, o Instituto de Revisão Clínica e Econômica dos EUA (ICER/Institute for Clinical and Economic Review), estimou que o custo seria de aproximadamente 10 dólares para 10 dias de terapia. Se os números do ICER estiverem corretos, a Gilead teria que cobrar cerca de 12,50 por paciente (incluindo os 25% de lucro), concluiu Fehlner.
Patente será liberada e o caso específico do Brasil
A Gilead, diante dos apelos mundiais, disse que iria abrir mão da patente, primeiramente para 127 países. O Brasil não estava incluso na lista, mas de acordo com a revista Exame, a questão é apenas burocrática: a Gilead afirmou que tem o compromisso de garantir acesso a todos os pacientes. O medicamento, atualmente, não tem autorização da Anvisa, ou seja, não está disponível no Brasil. Negociações com a Anvisa, já iniciaram, segundo a Gilead.
“Continuaremos a discutir com as autoridades regulatórias, incluindo no Brasil, o crescente corpo de evidências do remdesivir como um tratamento potencial para a covid-19, com o objetivo de torná-lo mais amplamente disponível para pacientes com necessidades urgentes”, disse em nota à EXAME. A empresa farmacêutica informou que se reuniu com a Anvisa no último dia 6 de maio para falar sobre o tema. “Na ocasião, a Gilead informou que o plano global de submissão para o remdesivir, incluindo o Brasil, está em fase de discussão interna”, ainda conforme informações da Exame.
Com a liberação da patente, o valor poderia ser ainda menor do que os 12,5o dólares (na cotação de hoje, 68,51 reais), já que países e governos têm amplo interesse em patrocinar a produção em massa, mesmo com as atuais lacunas que restam ser respondidas, tanto em termos clínicos como da disponibilidade de insumos para a produção.
Segundo informações do Milken Institute, existem atualmente 223 estudos clínicos em andamento para o tratamento da Covid-19 e 123 projetos que buscam encontrar uma vacina contra o vírus Sars-CoV-2.
Leia mais: Remdesivir e tocilizumabe mostram avanços como tratamento para a COVID-19